Identification of QTL for Pre-harvest Sprouting Resistance by Using Chromosome Segment Substitution Lines of Dongxiang Common Wild Rice
-
摘要:目的
高温阴雨天气导致水稻生产田出现穗发芽(Pre-harvest Sprouting, PHS), 种子活力降低, 严重影响水稻产量与品质性状。鉴定筛选抗穗发芽种质及基因资源是培育抗穗发芽水稻新品种、消除稻谷穗发芽产生危害的根本途径。
方法以强休眠、不易穗发芽的东乡野生稻‘C35’为供体亲本、较易穗发芽的‘日本晴’(NIP)为受体亲本构建的染色体片段置换系(CSSLs)群体为试验材料, 于2021—2023年进行抗穗发芽特性鉴定评价, 筛选抗穗发芽种质和鉴定主效QTL。
结果不同环境下东乡野生稻‘C35’休眠性较强、穗发芽率均为0.00%, ‘日本晴’存在明显穗发芽现象、穗发芽率均值为31.95%;CSSLs穗发芽率变幅较大, 不同年份穗发芽率表型重复性较好, 筛选到10份强休眠、抗穗发芽的种质; 共检测到14个控制穗发芽率QTL, 4个QTL在不同环境下被重复检测到, 相关QTL在染色体上形成qPHSRC1、qPHSRC2、qPHSRC8和qPHSRC9等4个QTL簇, 其中主效QTL簇qPHSRC2和qPHSRC9的LOD值、表型贡献率和加性效应值较大, qPHSRC2为新发现的主效QTL簇。
结论鉴定筛选出一批抗穗发芽的种质材料, 定位到14个抗穗发芽QTL, 筛选出4个重复性较好的QTL簇, 发现1个调控穗发芽率的新主效QTL簇qPHSRC2。
Abstract:ObjectiveHigh-temperature and rainy weather lead to pre-harvest sprouting (PHS), severely impacting yield and quality traits of rice. Identification and screening of germplasm or genetic resources is a fundamental pathway for developing new varieties resistant to PHS and eliminating PHS damage.
MethodIn the study, a set of chromosome segment substitution lines (CSSLs) derived from Dongxiang wild rice ('C35') as the donor parent and 'Nipponbare' ('NIP') as the recipient parent were used as the experimental materials, and then PHS resistance were evaluated and QTLs were mapped in 2021-2023, with an aim to screen PHS germplasm and identify major QTLs.
ResultDongxiang wild rice 'C35' exhibited strong dormancy under different environments with a pre-harvest sprouting rate (PHSR) of 0.00%; 'Nipponbare' showed significant PHS with an average PHSR of 31.95%. The PHSR varied widely among CSSL populations, the phenotypic repeatability of PHSR was relatively high in different years, and ten lines from the CSSL populations with strong dormancy and resistance to PHS were screened. A total of 14 QTLs controlling the PHSR were detected, and four QTLs were repeatedly detected under different environments. These QTLs formed four QTL clusters (qPHSRC1, qPHSRC2, qPHSRC8 and qPHSRC9), among which qPHSRC2 and qPHSRC9 had higher LOD values, phenotypic contribution rate (%) and additive effect, and qPHSRC2 was a newly discovered major QTL cluster.
ConclusionA batch of PHS resistant germplasms were screened and 14 QTLs were mapped, four QTL clusters were repeatedly identified, and a new major QTL cluster qPHSRC2 controlling the PHSR was discovered.
-
【研究意义】水稻(Oryza sativa L.)是我国乃至全球重要的粮食作物,确保稻谷安全生产对保障粮食安全至关重要[1]。谷物穗发芽导致种子活力降低、加工和食味品质变差,全球每年因谷物穗发芽造成重大的经济损失[2]。我国南方地区常规早稻、中稻灌浆-成熟期常面临高温、持续阴雨天气,稻谷收割前出现穗发芽,严重影响水稻产量与品质性状[3]。据统计,我国杂交水稻穗发芽率在2%~5%,极端天气年份甚至高达50%,随着全球气温升高、极端雨水天气频发,大面积穗发芽风险增加,严重威胁我国水稻生产和粮食安全[4-5]。鉴定水稻抗穗发芽种质、挖掘抗穗发芽基因资源是培育抗穗发芽新品种的重要途径,也是积极应对极端天气和保障粮食安全的关键。【前人研究进展】水稻穗发芽与种子休眠性是同一性状的两个极端表现,属于多基因控制的数量性状,受基因、种子自身状况和环境共同决定[5-6]。目前,已有超过200个水稻穗发芽或种子休眠相关QTL被定位,仅少数几个QTL/ 基因被精细定位或克隆[6]。杨彬[7]利用GWAS共定位到81个水稻穗发芽相关位点,仅12个位点在不同环境下稳定表达;杨锟等[8]利用构建的F2群体检测到9个水稻穗发芽QTL,其中主效QTL qPHS-12能稳定遗传,世代间重演性较好;PHS9编码一个CC型谷氧还蛋白,在胚胎发育后期特异性表达,与OsGAP互作整合抗氧化(Reactive oxygen species,ROS)与脱落酸(Abscisic acid,ABA)信号,调控水稻穗发芽程度[9];OsGA2ox9在子房和早期发育阶段的种子中表达水平相对较高,阻止胚中赤霉素(Gibberellins,GA)进入胚乳,抑制GA-可溶性糖-ABA的信号转导,阻止生长发育早期的种子萌发[10]。同时,种子自身状况(如成熟度、休眠性、内含物)和外界环境均会影响水稻种子穗发芽[11],如一般成熟度越高的种子,穗发芽率越高,稻穗上部籽粒穗发芽率最高、其次为稻穗中部籽粒[12-13];适宜环境下低休眠性品种穗萌率(即穗发芽率)显著增加,引入休眠基因可减少穗发芽[14];灌浆结实期,高温会导致灌浆速率加快,种子提前成熟,穗发芽明显增多[15]。此外,种子休眠与萌发受ABA与GA拮抗作用影响,已克隆的休眠或萌发基因大多与ABA和GA合成、降解及信号转导相关[16]。种子可溶性糖含量也与穗发芽关系密切,phs8突变体种子胚乳糖积累,OsABI3和OsABI5表达量降低,ABA敏感性降低,穗发芽率增加[17]。【本研究切入点】从长远来看,广泛开展水稻抗穗发芽种质资源鉴定评价,尤其在野生稻和地方品种中寻找丢失的休眠基因,并通过分子育种途径适度聚集此类基因,培育抗穗发芽的水稻新品种,是解决穗发芽问题的根本途径。以往研究鉴定水稻抗穗发芽基因甚少,抗穗发芽分子遗传机制尚不明确,仍有待进一步研究完善,鉴定挖掘调控水稻穗发芽的关键基因并阐明其分子遗传机制是关键核心。【拟解决的关键问题】本研究以强休眠性、不易穗发芽的东乡野生稻‘C35’为供体亲本、较易穗发芽的‘日本晴’(‘NIP’)为受体亲本构建的染色体片段置换系CSSLs为试验材料,于2021—2023年采用整穗发芽法鉴定评价其抗穗发芽特性,筛选抗穗发芽种质并鉴定主效QTL,以期为水稻抗穗发芽遗传改良提供优异基因资源。
1. 材料与方法
1.1 试验材料与田间种植
以东乡普通野生稻异位圃‘C35’株系为供体亲本、‘日本晴’(‘NIP’)为受体亲本构建的染色体片段置换系(CSSLs)为试验材料,包含114个家系,2021年将亲本和CSSLs种植于江西省农业科学院南昌试验田,2022—2023年种植于江西省农业科学院高安试验基地(宜春)。每个家系3行,每行8株,单苗栽插,行株间距均为20.0 cm×16.5 cm,其他田间管理同当地大田栽培管理。
1.2 穗发芽性状鉴定
于抽穗期调查抽穗情况,抽穗后35 d在每个家系中间行取3个单株主穗,纯水浸泡1 h后,平放于垫有两层湿润滤纸的塑料箱并覆保鲜膜保湿。将塑料箱放置于恒温光照培养箱(温度30±1 ℃,光照/ 黑暗各12 h),每天喷水保湿。第7天统计发芽数和实粒数,独立计算3个稻穗的发芽率(发芽数/ 实粒数×100,%),取均值作为统计单元。
1.3 穗发芽QTL分析
利用亲本间具有多态性的标记构建遗传图谱,共包含203个多态性分子标记,图谱覆盖基因组约373 239 kb,标记间平均距离为1 934.78 kb,平均每条染色体标记数为16.92个[18]。利用QTL ICI Mapping 4.2软件的RSTEP-LRTADD方法鉴定加性效应QTL[19],LOD阈值设定为2.00,当LOD值大于阈值时判定该区段存在1个QTL,并估算每个QTL加性效应值和贡献率;QTL命名遵循McCouch[20]原则。
2. 结果与分析
2.1 亲本及CSSLs穗发芽表型鉴定
双亲穗发芽率存在显著差异,其中东乡普通野生稻‘C35’休眠性较强,3年穗发芽率均为0.00%,具有较强的抗穗发芽特性,而‘日本晴’灌浆成熟后存在穗发芽情况,3年穗发芽率分别为18.7%、25.6% 和51.55%,穗发芽率均值为31.95%。不同年份环境下,CSSLs家系穗发芽率变幅较大,3年变幅分别为0.00%~81.10%、0.00%~83.46% 和0.00%~95.62%,均值在1.67%~ 75.21%,偏度值与峰度值接近于1.00,表现为连续分布,穗发芽率属于多基因控制的数量性状,符合QTL作图要求(图 1、图 2)。不同环境下穗发芽率表型存在极显著相关性,均值与各年份环境穗发芽率相关系数较大,分别为0.712、0.784和0.831,不同年份环境穗发芽表型重复性较好(表 1)。此外,筛选出10份3年穗发芽率均低于15.0% 的强休眠、不易穗发芽家系和15份穗发芽率均高于50% 的易穗发芽家系。抗穗发芽家系穗发芽率均值在0.88%~6.57%,其中CSSL14、CSSL22、CSSL26、CSSL62和CSSL74在3年环境下穗发芽率及均值都低于5.0%,具有较强的休眠性和抗穗发芽能力。
表 1 不同年份环境下穗发芽率相关性分析Table 1. Correlation analysis of PHSR under different years and environments
2.2 CSSLs抗穗发芽QTL鉴定
共检测到14个控制穗发芽率的QTL,2021年、2022年、2023年和3年穗发芽率均值分别检测到2个、4个、4个和4个,相关QTL分布于第1~2、第4~9号染色体上,LOD值介于2.15~4.19,单一QTL解释1.97%~14.06% 表型变异,加性效应值在-15.24~16.36,其中4个QTL(qPHSR1、qPHSR2、qPHSR8、qPHSR9)在不同环境下被重复检测到,其他QTL仅在单一环境下表达(表 2、图 3)。2021年环境下检测到2个穗发芽率相关的QTL、分别为qPHSR4a和qPHSR9a,其中qPHSR9a表型贡献率和加性效应值分别为14.06% 和-15.24,是一个主效QTL;2022年环境下检测到4个穗发芽率相关的QTL,分别为qPHSR1a、qPHSR6a、qPHSR8a和qPHSR9b,其中qPHSR1a表型贡献率最大、为10.73%,qPHSR9b加性效应值最大、为-11.15;2023年环境下检测到4个穗发芽率相关的QTL,分别为qPHSR2a、qPHSR4b、qPHSR5和qPHSR7,其中qPHSR2a的表型贡献率和加性效应值较大、分别为10.93% 和14.40;检测到3年穗发芽率均值相关的QTL 4个,分别为qPHSR1b、qPHSR2b、qPHSR6b和qPHSR8b,其中qPHSR2b的表型贡献率和加性效应值较大、分别为11.12% 和9.43。
表 2 利用 CSSLs 鉴定水稻穗发芽率 QTLTable 2. Identification of QTLs for rice PHSR by using the CSSLs
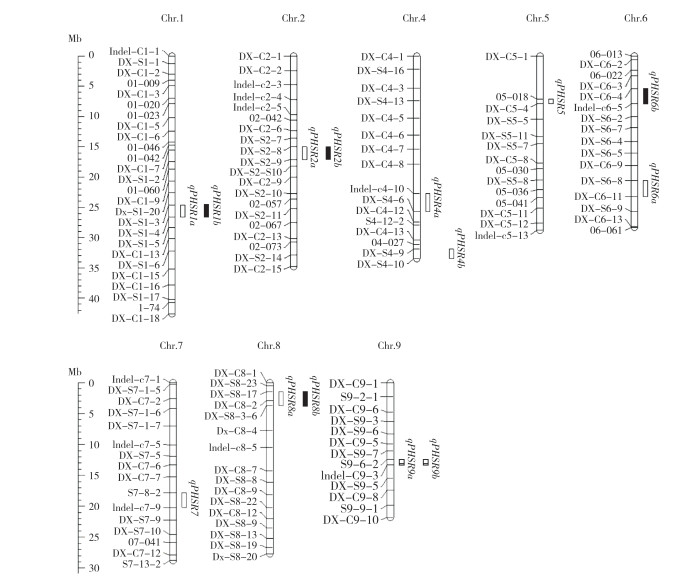
![]() 图 3 水稻CSSLs穗发芽率QTL在染色体上的分布
图 3 水稻CSSLs穗发芽率QTL在染色体上的分布此外,整合分析发现14个调控穗发芽率的QTL主要聚集于8条染色体的10个区段,形成4个QTL簇,qPHSRC1(qPHSR1a和qPHSR1b)位于1号染色体DX-S1-3~DX-S1-4标记间、qPHSRC2(qPHSR2a和qPHSR2b)位于2号染色体DX-S2-8~DX-S2-9标记间、qPHSRC8(qPHSR8a和qPHSR8b)位于8号染色体DXS8-17~DX-S8-3-6标记间、qPHSRC9(qPHSR9a和qPHSR9b)位于9号染色体S9-6-2~Indelc9-3标记间(图 3)。其中,qPHSRC2和qPHSRC9的LOD值、表型贡献率和加性效应值较大,是2个调控穗发芽的主效QTL簇,qPHSRC2增效等位基因来自东乡普通野生稻‘C35’,qPHSRC9增效等位基因来自‘日本晴’,均可显著调控穗发芽表型。
3. 讨论
穗发芽是指谷物收获前遭遇高温潮湿或连续阴雨天气诱导穗上籽粒发芽的现象,严重影响水稻、小麦等农作物种子活力、产量和品质[21-23]。水稻穗发芽与籽粒可溶性糖含量、α-淀粉酶活性密切相关,易穗发芽水稻种子α-淀粉酶活性、可溶性糖含量显著高于不易穗发芽材料[11, 21];穗发芽与休眠性受ABA和GA含量及动态变化调控,ABA诱导休眠、抑制萌发,GA解除休眠、促进萌发[16]。此外,温度和湿度是影响水稻穗发芽的主要环境因素,高温阴雨天气促进种子穗发芽,低温、干燥环境抑制水稻穗发芽[3]。本研究中,供体亲本东乡普通野生稻‘C35’具有强休眠性,穗发芽率接近于0%;受体亲本‘日本晴’和CSSLs穗发芽率在不同年份环境中存在明显变化,二者2023年穗发芽率显著高于其他年份及均值,这可能与2023年灌浆-成熟期的持续高温有关;抗穗发芽和易穗发芽极端家系穗发芽表型在不同年份稳定性较好,中间型材料表型受年际环境影响较大,鉴定出3年环境下穗发芽率及均值都低于15% 的抗穗发芽家系10份和穗发芽率均高于50% 的易穗发芽家系15份;不同年份穗发芽率呈显著正相关,均值与各年份穗发芽率呈极显著正相关。这表明穗发芽表型受环境和遗传因素共同决定,多环境重复鉴定有利于排除环境干扰,高效准确鉴定筛选出强休眠、抗穗发芽的优异种质。我们将继续利用不同基因型家系探索环境与遗传因素对穗发芽表型的影响及响应规律,为水稻抗穗发芽表型精准鉴定和基因克隆奠定基础。
目前,尽管喷施ABA、多效唑、烯效唑等抗穗萌化学药剂可在一定程度上抑制穗发芽,但易增加人力、物力成本,且会污染环境[24]。鉴定挖掘抗穗发芽种质及基因资源、培育抗穗发芽新品种是应对水稻穗发芽问题的关键途径[22]。水稻抗穗发芽和休眠性属于多基因控制的数量性状,已定位的QTL相对较多,广泛分布于第3、5、6、7、9和11号染色体[6, [8]。Dong等[25]利用RIL群体检测到6个水稻穗发芽相关QTL,贡献率为10.7%~25.3%;Gao等[26]利用保持系‘冈46B’和‘K81’杂交构建F2群体,鉴定了3个水稻穗发芽抗性相关QTL,分别为qPSR2、qPSR5和qPSR8,其中主效QTL qPSR8位于8号染色体长臂末端,表型贡献率达43.04%;Cheon等[27]在不同环境检测到5个水稻穗发芽率QTL,分别为qPHS- 3FD、qPHS-11FD、qPHS-3GH、qPHS-4GH和qPHS-11GH,其中qPHS-11GH和qPHS-11FD在不同环境下稳定表达;Wang等[28]利用强休眠品种‘N22’和弱休眠品种‘南粳35’杂交衍生群体精细定位了抗穗发芽QTL qSd-1-1,目标基因编码一个类似DOG1蛋白;Mizuno等[29]利用CSSLs定位并验证了2个主效QTL qSDR9.1和qSDR9.2,其中qSDR9.2与OsDSG1位于相同染色体区域。本研究共检测到14个穗发芽QTL,qPHSR1b、qPHSR2b、qPHSR6b和qPHSR8b为调控3年环境穗发芽率均值的QTL,其中qPHSR2b表型贡献率和加性效应值较大、分别为11.12% 和9.43。此外,相关QTL形成4个QTL簇qPHSRC1(qPHSR1a和qPHSR1b)、qPHSRC2(qPHSR2a和qPHSR2b)、qPHSRC8(qPHSR8a和qPHSR8b)、qPHSRC9(qPHSR9a和qPHSR9b),其中qPHSRC2和qPHSRC9贡献率和加性效应值较大,是两个调控抗穗发芽特性的主效QTL簇。比较分析表明,qPHSRC8与Gao等[26]定位的主效QTL qPSR8虽然均位于8号染色体,但是染色体区段不同,而表型贡献率和加性效应值较大的qPHSRC9与Wang等[28]、Mizuno等[29]定位的qSDR9.2/OsDSG1位于相同染色体区域,在不同群体中重演性较好;qPHSRC1、qPHSRC2和qPHSRC8是新发现的3个调控水稻抗穗发芽的QTL簇,其中qPHSRC2的表型贡献率和加性效应值较大,是一个调控水稻抗穗发芽的主效QTL簇。后续研究将利用含有目标QTL染色体片段的家系构建次级群体,以期精细定位和解析目标QTL/ 基因的生物学功能。
4. 结论
本研究以强休眠、不易穗发芽的东乡普通野生稻‘C35’与较易穗发芽的‘日本晴’为亲本杂交-回交构建的染色体片段置换系CSSLs为试验材料,3年重复鉴定抗穗发芽特性,筛选出10份强休眠、抗穗发芽的家系;共检测到控制不同年份环境穗发芽率及均值QTL 14个,形成4个稳定表达的QTL簇qPHSRC1、qPHSRC2、qPHSRC8和qPHSRC9,其中qPHSRC1、qPHSRC2和qPHSRC8为新发现的水稻抗穗发芽QTL簇,主效QTL簇qPHSRC2的表型贡献率和加性效应值较大,增效等位基因来自东乡野生稻‘C35’。研究鉴定筛选了多个强休眠、抗穗发芽种质及主效QTL簇,为抗穗发芽目标QTL/ 基因的精细定位和功能分析奠定了基础。
【责任编辑 马春敏】 -
图 3 水稻CSSLs穗发芽率QTL在染色体上的分布
Figure 3. Distribution of QTLs detected for PHSR on the chromosome in rice CSSLs
表 1 不同年份环境下穗发芽率相关性分析
Table 1 Correlation analysis of PHSR under different years and environments

表 2 利用 CSSLs 鉴定水稻穗发芽率 QTL
Table 2 Identification of QTLs for rice PHSR by using the CSSLs

-
[1] SHI J, SHI J X, LIANG W Q, ZHANG D B. Integrating GWAS and transcriptomics to identify genes involved in seed dormancy in rice [J]. Theoretical and Applied Genetics, 2021, 134(11): 1-10. DOI: 10.1007/S00122-021-03911-1.
[2] 刘佳影, 苏治源, 李秋萍, 刘泽茜, 徐嘉欣, 刘婷婷, 刘睿, 刘钰婷, 何宇欣, 邓飞, 任万军. 田间穗发芽对四川盆地中籼稻稻米品质的影响[J]. 四川农业大学学报, 2024, 42(3): 490-498, 522. DOI: 10.16036/j.issn.1000-2650.202312343. LIU J Y, SU Z Y, LI Q P, LIU Z X, XU J X, LIU T T, LIU R, LIU Y T, HE Y X, DENG F, REN W J. Influence of pre-harvest sprouting on rice quality of medium indica rice in Sichuan Basin[J]. Journal of Sichuan Agricultural University, 2024, 42(3): 490-498, 522. DOI: 10.16036/j.issn.1000-2650.202312343.
[3] 管玉圣, 欧阳杰, 郭爽, 黄乾龙, 王静. 水稻穗发芽的温度效应及抗性种质筛选[J]. 南方农业, 2018, 12(31): 32-34. DOI: 10.19415/j.cnki.1673-890x.2018.31.009. GUAN Y S, OUYANG J, GUO S, HUANG Q L, WANG J. Temperature effect and resistant germplasm screening of panicle sprouting in rice [J]. South China Agriculture, 2018, 12(31): 32-34. DOI: 10.19415/j.cnki.1673-890x.2018.31.009.
[4] 周述波, 林伟, 贺立静, 萧浪涛, 张雪芹. 水稻穗上芽发生的生理变化初步研究[J]. 杂交水稻, 2011, 26(4): 68-71. DOI: 10.16267/j.cnki.1005-3956.2011.04.030. ZHOU S B, LIN W, HE L J, XIAO L T, ZHANG X Q. Studies on the physiological changes of pre-harvest sprouting in rice [J]. Hybrid Rice, 2011, 26(4):68-71. DOI: 10.16267/j.cnki.1005-3956.2011.04.030.
[5] 张琪, 贾俊婷, 张爱霞, 刘文华, 陈兵先. 水稻穗发芽研究进展[J]. 广东农业科学, 2022, 49(11): 128-137. DOI: 10.16768/j.issn.1004-874X.2022.11.014. ZHANG Q, JIA J T, ZHANG A X, LIU W H, CHEN B X. Research progress in pre-harvest sprouting of rice[J]. Guangdong Agricultural Sciences, 2022, 49(11): 128-137. DOI: 10.16768/j.issn.1004-874X.2022.11.014.
[6] 林鑫焱, 张传忠, 戴兵, 王馨珩, 刘剑锋, 温丽, 徐兴健, 方军. 水稻穗发芽遗传与分子机制的研究进展[J]. 生物技术通报, 2024, 40(1): 24-31. DOI: 10.13560/j.cnki.biotech.bull.1985.2023-0786. LING X Y, ZHANG C Z, DAI B, WANG X H, LIU J F, WEN L, XU X J, FANG J. Advances in genetic and molecular mechanisms of preharvest sprouting in rice[J]. Biotechnology Bulletin, 2024, 40(1): 24-31. DOI: 10.13560/j.cnki.biotech.bull.1985.2023-0786.
[7] 杨彬. 水稻种子休眠相关基因发掘及功能分析[D]. 南京: 南京农业大学, 2019. DOI: 10.27244/d.cnki.gnjnu.2019.002230. YANG B. Identification and functional analysis of genes involved in seed dormancy in rice (Oryza sativa L.)[D]. Nanjing: Nanjing Agricultural University, 2019. DOI: 10.27244/d.cnki.gnjnu.2019.002230.
[8] 赵佳梁, 吴保为, 曾博虹, 欧阳冬梅, 曹志斌. 水稻幼穗在不同高温胁迫处理下的转录组对比分析[J]. 江西农业学报, 2024, 36(8): 21-29. DOI: 10.19386/j.cnki.jxnyxb.2024.08.004. ZHAO J L, WU B W, ZENG B H, OUYANG D M, CAO Z B. Comparative analysis of rice young panicle transcriptome under different high-temperature stress treatments[J]. Acta Agriculturae Jiangxi, 2024, 36(8): 21-29. DOI: 10.19386/j.cnki.jxnyxb.2024.08.004.
[9] XU F, TANG J Y, GAO S P, CHENG X, DU L, CHU C C. Control of rice pre-harvest sprouting by glutaredoxin-mediated abscisic acid signaling[J]. The Plant Journal: For Cell and Molecular Biology, 2019, 100(5): 1036-1051. DOI: 10.1111/tpj.14501.
[10] XING M Q, CHEN S H, ZHANG X F, XUE H W. Rice OsGA2ox9 reg ulates seed GA met a bolism a nd dor ma ncy[J]. Plant Biotechnology Journal, 2023, 21(12): 2411-2413. DOI: 10.1111/PBI.14067.
[11] 余木兰, 唐宁, 夏玉梅, 卜小兰, 詹祎捷, 淡俊豪, 石跃斌, 曹孟良. 水稻穗萌机制及调控的研究进展[J]. 杂交水稻, 2020, 35(5): 1-6. DOI: 10.16267/j.cnki.1005-3956.20200414.128. YU M L, TANG N, XIA Y M, BU X L, ZHAN Y J, DAN J H, SHI Y B, CAO M L. Research progress on the mechanism and regulation of rice pre-harvest sprouting[J]. Hybrid Rice, 2020, 35(5): 1-6. DOI: 10.16267/j.cnki.1005-3956.2020414.128.
[12] 赵庆勇, 陈涛, 赵春芳, 梁文化, 赵凌, 姚姝, 周丽慧, 朱镇, 张亚东, 王才林. 粳稻穗发芽的品种(系) 间差异及其影响因素分析[J]. 江苏农业学报, 2017, 33(3): 481-486. DOI: 10.3969/j.issn.1000-4440.2017.03.001. ZHAO Q Y, CHEN T, ZHAO C F, LIANG W H, ZHAO L, YAO S, ZHOU L H, ZHU Z, ZHANG Y D, WANG C L. Varietal difference of pre-harvest sprouting and its influencing factors in rice[J]. Jiangsu Journal of Agricultural Sciences, 2017, 33(3): 481-486. DOI: 10.3969/j.issn.1000-4440.2017.03.001.
[13] 宋建, 张薇, 范宏环, 崔永涛, 王建军. 不同晚粳稻品种类型间穗发芽比较与影响因素分析[J]. 浙江农业科学, 2023, 64(1): 71-74. DOI: 10.16178/j.issn.0528-9017.20220664. SONG J, ZHANG W, FAN H H, CUI Y T, WANG J J. Varietal difference of panicle sprouting and its influencing factors in late japonica rice[J]. Journal of Zhejiang Agricultural Sciences, 2023, 64(1): 71-74. DOI: 10.16178/j.issn.0528-9017.20220664.
[14] MAO X X, ZHANG J J, LIU W G, YAN S J, LIU Q, FU H, ZHAO J L, HUANG W J, DONG J F, ZHANG S H, YANG T F, YANG W, LIU B, WANG F. The MKKK62-MKK3-MAPK7/14 module negatively regulates seed dormancy in rice[J]. Rice, 2019, 12(1): 2. DOI: 10.1186/s12284-018-0260-z.
[15] 徐凯, 黄成裕, 韦军, 霍金兰. 2021年盐都区水稻灌浆结实期灾情调查及成因分析[J]. 大麦与谷类科学, 2022, 39(3): 58-63. DOI: 10.14069/j.cnki.32-1769/s.2022.03.009. XU K, HUANG C Y, WEI J, HUO J L. Investigation of the causes of rice production losses in the grain filling stage in Yandu District in 2021[J]. Barley and Cereal Sciences, 2022, 39(3): 58-63. DOI: 10.14069/j.cnki.32-1769/s.2022.03.009.
[16] SHU K, LIU X D, XIE Q, HE Z H. Two faces of one seed: Hormonal regulation of dormancy and germination[J]. Molecular Plant, 2016, 9(1): 34-45. DOI: 10.1016/j.molp.2015.08.010.
[17] DU L, XU F, FANG J, GAO S P, TANG J Y, FANG S, WANG H R, TONG H N, ZHANG F X, CHU J F, WANG G D, CHU C C. Endosperm sugar accumulation caused by mutation of PHS8/ISA1 leads to pre-harvest sprouting in rice[J]. The Plant Journal: For Cell and Molecular Biology, 2018, 95(3): 545-556. DOI: 10.1111/tpj.13970.
[18] MA X D, HAN B, TANG J H, ZHANG J N, CUI D, GENG L Y, ZHOU H Y, LI M M, HAN L Z. Construction of chromosome segment substitution lines of Dongxiang common wild rice (Oryza rufi fi pogon Griff. ) in the background of the japonica rice cultivar Nipponbare (Oryza sativa L.)[J]. Plant Physiology and Biochemistry, 2019, 144: 274-282. DOI: 10.1016/j.plaphy.2019.09.041.
[19] WANG J K, LI H H, ZHANG L Y. QTL ICI Mapping V4.0[OL]. http://www.isbreeding.net.
[20] MCCOUCH S R. Gene nomenclature system for rice[J]. Rice, 2008, 1: 72-84. DOI: 10.1007/s12284-008-9004-9.
[21] TAI L, WANG H J, XU X J, SUN W H, JU L, LIU W T, LI W Q, SUN J Q, CHEN K M. Pre-harvest sprouting in cereals: Genetic and biochemical mechanisms[J]. Journal of Experimental Botany, 2021, 72(8): 2857-2876. DOI: 10.1093/jxb/erab024.
[22] 乔唱唱, 张冬霞, 沈思涵, 马嵩科, 张静, 张俊豪, 柴雪茹, 王贺正. 秸秆还田配施磷肥对旱地小麦土壤养分和磷素利用率的影响[J]. 江西农业学报, 2024, 36(9): 26-34. DOI: 10.19386/j.cnki.jxnyxb.2024.09.004. QIAO C C, ZHANG D X, SHEN S H, MA S K, ZHANG J, ZHANG J H, CHAI X R, WANG H Z. Effect of straw returning with phosphate fertilizer on soil nutrient and phosphate utilization rate in dryland wheat[J]. Acta Agriculturae Jiangxi, 2024, 36(9): 26-34. DOI: 10.19386/j.cnki.jxnyxb.2024.09.004.
[23] 赵小光, 翟周平, 尚毅, 柴靓, 赵鹏涛. 小麦远源杂交种光合性状的杂种优势分析[J]. 江西农业学报, 2023, 35(3): 1-6. DOI: 10.19386/j.cnki.jxnyxb.2023.03.001. ZHAO X G, ZHAI Z P, SHANG Y, CHAI L, ZHAO P T. Heterosis analysis of photosynthetic characters of wheat distant hybrids[J]. Acta Agriculturae Jiangxi, 2023, 35(3): 1-6. DOI: 10.19386/j.cnki.jxnyxb.2023.03.001.
[24] 王业文, 张莹, 靳西彪, 魏毅, 朱建清. 抗穗萌药剂组合的筛选及其抑制种子发芽的同功酶电泳研究[J]. 种子, 2008(8): 18-21. DOI: 10.16590/j.cnki.1001-4705.2008.08.054. WA NG Y W, ZH A NG Y, J I N X B, W EI Y, ZHU J Q. T he selection of ihibitors pre-harvest sprouting in rice and study on eletrophoretic analysis[J]. Seed, 2008(8): 18-21. DOI: 10.16590/j.cnki.1001-4705.2008.08.054.
[25] DONG Y J, TSUZUKI E, KAMIUNTEN H, TERAO H, LIN D Z, MATSUO M, ZHENG Y F. Identification of quantitative trait loci associated with pre-harvest sprouting resistance in rice (Oryza sativa L.)[J]. Field Crops Research, 2003, 81(2): 133-139. DOI: 10.1016/S0378-4290(02)00217-4.
[26] GAO F Y, REN G J, LU X J, SUN S X, LI H J, GAO Y M, LUO H, YAN W G, ZHANG Y Z. QTL analysis for resistance to pre-harvest sprouting in rice (Oryza sativa)[J]. Plant Breeding, 2008, 127(3): 268-273. DOI: 10.1111/j.1439-0523.2007.01450.x.
[27] CHEON K S, WON Y J, JEONG Y M, LEE Y Y, KANG D Y, OH J, OH H, KIM S L, KIM N, LEE E, YOON I S, CHOI I, BAEK J, KIM K H, PARK H S, JI H. QTL mapping for pre-harvest sprouting resistance in japonica rice varieties utilizing genome re-sequencing [J]. Molecular Genetics and Genomics, 2020, 295(5): 1129-1140. DOI: 10.1007/s00438-020-01688-4.
[28] WANG Q, LIN Q B, WU T, DUAN E C, HUANG Y S, YANG C Y, MOU C L, LAN J, ZHOU C L, XIE K, LIU X, ZHANG X, GUO X P, WANG J, JIANG L, WAN J M. OsDOG1L-3 regulates seed dormancy through the abscisic acid pathway in rice[J]. Plant Science, 2020, 298: 110570. DOI: 10.1016/j.plantsci.2020.110570.
[29] MIZUNO Y, YAMANOUCHI U, HOSHINO T, NONOUE Y, NAGATA K, FUKUOKA S, ANDO T, YANO M, SUGIMOTO K. Genetic dissection of pre-harvest sprouting resistance in an upland rice cultivar[J]. Breeding Science, 2018, 68(2): 200-209. DOI: 10.1270/jsbbs.17062.




 下载:
下载: